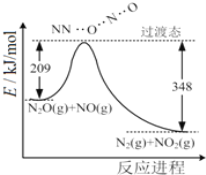
【題目】(1)由N2O和NO反應生成N2和NO2的能量變化如圖所示,若生成1molN2���,其△H=___kJ·mol-1。
(2)已知:①C(s)+O2(g)=CO2(g) ΔH=akJ·mol-1
②CO2(g)+C(s)=2CO(g) ΔH=bkJ·mol-1
③Si(s)+O2(g)=SiO2(s) ΔH=ckJ·mol-1
工業(yè)上生產(chǎn)粗硅的熱化學方程式為__���。
(3)在烴分子中去掉2個氫原子形成一個雙鍵是吸熱反應,大約需117kJ/mol~125kJ/mol的熱量�,但1,3—環(huán)己二烯失去2個氫原子變成苯是放熱反應��,△H=-23.4kJ/mol�,以上事實表明苯加氫生成環(huán)己烷是__反應。(填放熱或吸熱)
(4)X�����、Y兩元素的原子���,當它們分別獲得兩個電子形成稀有氣體元素電子層結構時�,X放出的熱量大于Y放出的熱量;Z�����、W兩元素的原子�,當它們分別失去一個電子形成稀有氣體元素原子的電子層結構時�����,吸收能量W大于Z��。則X�����、Y和Z��、W分別形成的化合物中��,離子化合物可能性最大的是__���。(填化合物的化學式)
(5)稱取等質(zhì)量為(ag)膽礬兩份�。把一份溶于bg水中����,測知其溶解時吸收Q1kJ熱量�����;把另一份脫水后溶于bg水中��,測得其溶解時放熱Q2kJ����。從以上數(shù)據(jù)可知���,1mol膽礬脫水需__kJ熱量。